Trắc nghiệm Hoá học 10 Cánh diều Bài 5 Lớp, phân lớp và cấu hình electron
Bài trắc nghiệm có đáp án. Câu hỏi và bài tập trắc nghiệm Hoá học 10 Bài 5 Lớp, phân lớp và cấu hình electron - sách Cánh diều . Học sinh luyện tập bằng cách chọn đáp án của mình trong từng câu hỏi. Dưới cùng của bài trắc nghiệm, có phần xem kết quả để biết bài làm của mình. Kéo xuống dưới để bắt đầu.
Câu 1: Nguyên lí hay quy tắc nào bị vi phạm trong cấu hình theo ô orbital được cho dưới đây?
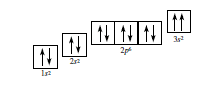
- A. Quy tắc Klechkovski.
- B. Không vi phạm nguyên lí, quy tắc nào.
C. Nguyên lí Pauli.
- D. Quy tắc của Hund.
Câu 2: Các electron của nguyên tử nguyên tố X được phân bố trên 3 lớp, lớp thứ 3 có 7 electron. Số đơn vị điện tích hạt nhân của nguyên tử nguyên tố X là?
- A. 7.
- B. 9
- C. 15
D. 17.
Câu 3: Cấu hình electron nguyên tử ở trạng thái cơ bản nào là đúng cho nguyên tử có số hiệu nguyên tử là 16?
- A. 1s2 2s2 2p6 3s2 3p3 4s1
B. 1s2 2s2 2p6 3s2 3p4.
- C. 1s2 2s2 2p6 3s1.
- D. 1s2 2s2 2p2 3p2 4p2 5p1.
Câu 4: Cấu hình nào sau đây vi phạm nguyên lí Pauli?
- A. 1s22s22p3.
- B. 1s22s22p4.
C. 1s22s22p63s3.
- D. 1s2.
Câu 5: Nguyên tử của nguyên tố X có sự sắp xếp electron trên các orbital của nguyên tử như hình dưới đây. X là nguyên tố nào?
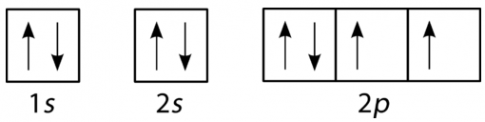
- A. Carbon (Z = 6).
- B. Nitrogen (Z = 7).
C. Oxygen (Z = 8).
- D. Fluorine (Z = 9).
Câu 6: Nhận xét nào đúng về sự sắp xếp electron trên các orbital của nguyên tử dưới đây?
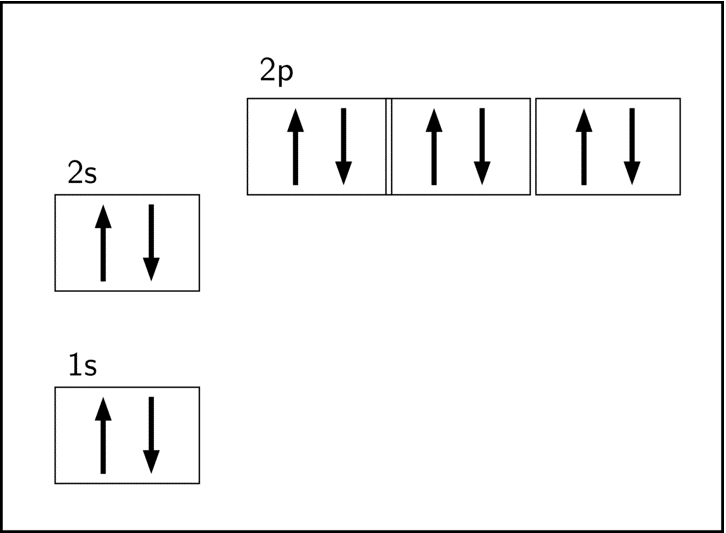
- A. Tất cả các mũi tên phải hướng lên trên.
B. Sự sắp xếp các electron trên các orbital của nguyên tử trên là hoàn toàn chính xác.
- C. Trong orbital 2p chỉ nên có 1 electron trong ô 2p đầu tiên và một electron trong ô 2p thứ hai.
- D. Cả hai mũi tên trong ô 2p phải hướng lên trên.
Câu 7: Cho cấu hình electron nguyên tử của các nguyên tố sau:
X. 1s2 2s2 2p6 3s2; Y. 1s2 2s2 2p6 3s2 3p6 4s1;
Z. 1s2 2s2 2p6 3s2 3p3; T. 1s2 2s2 2p6 3s2 3p6 3d8 4s2.
Dãy cấu hình electron của các nguyên tử nguyên tố kim loại là
- A. X, Y, Z.
B. X, Y, T.
- C. X, Z, T.
- D. Y, Z, T.
Câu 8: Một ion R3+ có phân lớp cuối cùng là 3d5. Cấu hình electron của nguyên tử R là
- A. 1s2 2s2 2p6 3s2 3p2 4s2 3d8.
B. 1s2 2s2 2p6 3s2 3p6 3d6 4s2.
- C. 1s2 2s2 2p6 3s2 3p6 3d5 4s2 4p1.
- D. 1s2 2s2 2p6 3s2 3p6 3d5 4s3
Câu 9: Cấu hình electron nào sau đây không đúng?
- A. 1s22s22p63s2.
- B. 1s22s22p63s23p5.
- C. 1s22s22p5.
D. 1s22s22p63s23p34s2.
Câu 10. Cấu hình theo ô orbital của một số nguyên tố được cho dưới đây. Cấu hình electron của nguyên tử nguyên tố là
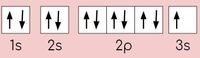
- A. 1s2 2s2 2p5 3s1.
- B. 1s1 2s1 2p3 3s1.
- C. 1s22s22p63s2.
D. 1s22s22p63s1.
Câu 11: Nguyên tử nguyên tố Y có tổng số electron trên các phân lớp p là 11. Nguyên tố Y là
- A. Potassium (Z = 19).
B. Chlorine (Z = 17).
- C. Fluorine (Z = 9).
- D. Sulfur (Z = 16).
Câu 12: Nguyên tử của nguyên tố Aluminium có 13 electron. Kết luận nào sau đây đúng?
A. Lớp electron ngoài cùng của Aluminium có 3e.
- B. Lớp electron ngoài cùng của Aluminium có 1e.
- C. Lớp L (lớp thứ 2) của Aluminium có 3e hay nói cách khác là lớp electron ngoài cùng của Aluminium có 3e.
- D. Lớp L (lớp thứ 2) của Aluminium có 6e.
Câu 13: Số electron tối đa trong lớp M là
- A. 2.
- B. 8.
C. 18.
- D. 32.
Câu 14: Cấu hình electron ở trạng thái cơ bản của nguyên tử kim loại nào sau đây có electron độc thân ở orbital s? (Cho số hiệu nguyên tử của Cr = 24, Ni = 28, Co = 27, Fe = 26)
A. Chromium
- B. Nickel
- C. Cobalt
- D. Iron
Câu 15: Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3s. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3s và có 5 electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 3. Nguyên tố X, Y lần lượt là
A. kim loại và phi kim.
- B. phi kim và kim loại.
- C. khí hiếm và kim loại.
- D. kim loại và khí hiếm.
Câu 16: Ở trạng thái cơ bản, nguyên tử của nguyên tố nào dưới đây có electron độc thân? (Cho số hiệu nguyên tử của He = 2, Ne = 10, B = 4, Mg = 12)
- A. Helium.
- B. Neon
C. Boron.
- D. Magnesium.
Câu 17: Cấu hình electron của Cu (Z = 29) là
A. 1s2 2s2 2p6 3s2 3p6 3d10 4s1
.- B. 1s2 2s2 2p6 3s2 3p6 3d9 4s2.
- C. 1s2 2s2 2p6 3s2 3p6 4s2 3d9.
- D. 1s2 2s2 2p6 3s2 3p6 4s2 3d10.
Câu 18: Các electron của nguyên tố X được phân bố trên 2 lớp, lớp thứ 2 có 7 electron. Số hiệu nguyên tử của nguyên tố X là
- A. 7.
- B. 10.
C. 9.
- D. 8.
Câu 19: Nguyên tử của nguyên tố hoá học A (Z = 20) có cấu hình electron ở lớp ngoài cùng là
- A. 3s2 3p2.
- B. 3s2 3p4.
- C. 3s2 3p6.
D. 4s2.
Câu 20: Ion X2+ có cấu hình electron là 1s2 2s2 2p6. Nguyên tố X là
- A. O (Z = 8).
B. Mg (Z = 12).
- C. Na (Z = 11).
- D. Ne (Z= 10).
