Giải SBT bài 10 Quy tắc Octet
56 tiết học trong chương trinh Hoá 10 Kết Nối Tri Thức đều được Giaibaitapsgk tổng hợp qua những câu hỏi trắc nghiệm ngắn gọn. Các em có thể lựa chọn bộ câu hỏi tương ứng với từng tuần học để ôn tập kiến thức. Hơn nữa, các em học sinh có thể trực tiếp chọn câu trả lời và đối chiếu đáp án tự động ngay cuối trang siêu tiện lợi.
Hướng dẫn giải bài 10 Quy tắc Octet trang 28 SBT Hoá học 10. Đây là vở bài tập nằm trong bộ sách "Kết nối tri thức với cuộc sống" được biên soạn theo chương trình đổi mới của Bộ giáo dục. Hi vọng, với cách hướng dẫn cụ thể và giải chi tiết học sinh sẽ nắm bài học tốt hơn.
NHẬN BIẾT
10.1. Liên kết hoá học là
A. sự kết hợp của các hạt cơ bản hình thành nguyên tử bền vững.
B. sự kết hợp giữa các nguyên tử tạo thành phân tử hay tỉnh thể bền vững hơn.
C. sự kết hợp của các phân tử hình thành các chất bền vững.
D. sự kết hợp của chát tạo thành vật thể bền vững.
Đáp án: B
10.2. Theo quy tắc octet, khi hình thành liên kết hoa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững giống như
A. kim loại kiềm gần kề.
B. kim loại kiêm thổ gân kề.
C. nguyên tử halogen gần kề.
D. nguyên tử khí hiếm gần kề.
Đáp án: D
10.3. Khi hình thành liên kết hoá học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt cấu hình electron bền vững theo quy tắc octet?
A.(Z = 12). B.(Z = 9). C.(Z = 11). D.(Z = 10).
Đáp án: A
Cấu hình electron của:
Nguyên tử nguyên tố có Z = 12: $1s^{2}2s^{2}2p^{6}3s^{2}$ có xu hướng nhường 2e để đạt cấu hình electron bền vững theo quy tắc octet. → chọn phương án A.
Nguyên tử nguyên tố có Z = 9: $1s^{2}2s^{2}2p^{5}$ có xu hướng nhận 1e để đạt cấu hình electron bền vững theo quy tắc octet.
Nguyên tử nguyên tố có Z = 11: $1s^{2}2s^{2}2p^{6}3s^{1}$ có xu hướng nhường 1e để đạt cấu hình electron bền vững theo quy tắc octet.
Nguyên tử nguyên tố có Z = 10: $1s^{2}2s^{2}2p^{6}$ có cấu hình electron bền vững theo quy tắc octet.
10.4. Công thức cầu tạo nào sau đây không đủ electron theo quy tắc octet?
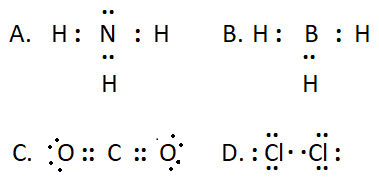
Đáp án: B. Do nguyên tử trung tâm chỉ có 6e
THÔNG HIỂU
10.5. Trong công thức CS2, tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là
A.2. B.3. C. 4. D.5.
Đáp án: C
Phân tử CS2 được biểu diễn: → tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là 4.
→ tổng số cặp electron lớp ngoài cùng của C và S chưa tham gia liên kết là 4.
10.6. Phân tử nào sau đây có các nguyên tử đều đã đạt cấu hình electron bão hoà theo quy tắc octet?
A. BeH2. B. AICl3. C. PCl5. D. SiF4.
Đáp án: D
Phân tử BeH2 được biểu diễn H : Be : H
Phân tử AICl3 được biểu diễn 
Phân tử PCl5 được biểu diễn 
Phân tử SiF4 được biểu diễn 
10.7. Quy tắc octet không đúng với trường hợp phân tử chất nào sau đây?
A. H2O. B. NO2. C. CO2. D.CI2.
Đáp án: B
Phân tử H2O được biểu diễn 
Phân tử NO2 được biểu diễn 
Phân tử CO2 được biểu diễn ![]()
Phân tử CI2 được biểu diễn ![]()
10.8. Trong tự nhiên, các khí hiếm tồn tại dưới dạng nguyên tử tự do. Các nguyên tử của khí hiếm không liên kết với nhau tạo thành phân tử và rất khó liên kết với các nguyên tử của các nguyên tô khác. Ngược lại nguyên tử các nguyên tố khác lại liên kết với nhau tạo thành phân tử hay tinh thể. Giải thích.
- Nguyên tử khí hiếm đều có cấu hình electron bão hoà là $ns^{2}np^{6}$ (trừ helium có cấu hình $1s^{2}$ làm cho nguyên tử khí hiếm rất bền vững nên các nguyên tử khí hiếm rất khó tham gia phản ứng hoá học. Trong tự nhiên, các khí hiếm đều tồn tại ở trạng thái nguyên tử (hay còn gọi là phân tử một nguyên tử) tự do, bền vững (nên còn gọi là các khí trơ).
- Nguyên tử của các nguyên tố khác có xu hướng liên kết với nhau để đạt được cấu hình electron bền vững của khí hiếm, ví dụ: H2, Cl2, HCI, CO2,... hay tự tập hợp lại thành các khối tinh thể, ví dụ: tinh thể NaCl,...
10.9. Cấu hình electron lớp ngoài cùng của nguyên tử potassium (kali) là $4s^{1}$,cấu hình electron lớp ngoài cũng của nguyên tử bromine là $4s^{2}4p^{5}$. Làm thế nào các nguyên tử potassinum vá bromine có được cấu hình electron của nguyên tử khi hiếm theo quy tắc octet.
- Nguyên tử potassium chỉ có 1 electron ở lớp ngoài cùng nên dễ dàng nhường đi 1 electron này để tạo thành ion dương. lon dương ($K^{+}$) có cấu hình elecron lớp ngoài cùng giống với khí hiếm argon ($3s^{2}3p^{6}$) đứng trước potassium trong bảng tuần hoàn.
- Nguyên tử bromine có 7 electron ở lớp electron ngoài cùng nên dễ dàng nhận thêm 1 electron tạo ra anion bromide ($Br^{-}$) có cấu hình electron lớp ngoài cùng giống với khí hiếm krypton ($4s^{2}4p^{6}$), đứng sau bromine trong bảng tuần hoàn.
10.10. Khi hình thành liên kết H + CI → HCI và khi phá vỡ liên kết HCI → H + CI thì hệ thu năng lượng hay toả năng lượng. Năng lượng phân tử HCI lớn hơn hay nhỏ hơn năng lượng hệ hai nguyên tử H và CI riêng rẽ? Trong hai hệ đó thì hệ nào bền hơn?
- Khi hình thành liên kết H + Cl → H-CI thì hệ toả ra năng lượng và ngược lại khi phá vỡ liên kết H-CI → H + CI thì hệ thu thêm năng lượng.
- Xét về mặt năng lượng thì phân tử H-CI có năng lượng nhỏ hơn hệ hai nguyên tử H và Cl riêng rẽ. Trong hai hệ đó thì hệ H-CI bền hơn hệ H và CI.
10.11. Trong phân tử Na2S, cấu hình electron của các nguyên tử có tuân theo quy tắc octet không?
Cấu hình electron của nguyên tử Na:

Cấu hình electron của nguyên tử S:

Khi Na kết hợp với S, mỗi nguyên tử Na nhường đi 1 electron hoá trị duy nhất để tạo thành cation Na$^{+}$ có 8 electron ở vỏ nguyên tử giống với khí hiếm neon.
Nguyên tử S có 6 electron hóa trị nhận thêm 2 electron từ hai nguyên tử Na tạo thành ion sulfide $S^{2-}$ có 8 electron ở vỏ nguyên tử giống với khí hiếm argon.
VẬN DỤNG
10.12. Vận dụng quy tắc octet để giải thích sự hình thành liên kết trong các phân tử O2, CO2, CaCl2, KBr.
phân tử O2![]()
phân tử CO2![]()
phân tử KBr![]()
phân tử CaCl2 ![]()
10.13. Đá vôi (thành phần chính là CaCO3) được dùng để sản xuất vôi, trong lĩnh vực xây dựng.... Bariun nitrate Ba(NO3)2 có trong thành phần của kính quang học, gốm, men,.. Phèn đơn aluminium sulfate (thành phần chính là Al2(SO4)3 được sử dụng rộng rãi trong xử lí nước thải, trong công nghệ sản xuất giấy, công nghệ nhuộm vải và công nghệ lọc nước và nuôi trồng thuỷ sản....Dựa vào quy tắc octet, đề xuất công thức cấu tạo của các chất trên.
- Phân tử CaCO3:

- Phân tử Ba(NO3)2

- Phân tử Al2(SO4)3

10.14. Hợp chất X tạo bởi hai nguyên tố A, D có khối lượng phân tử là 76. X là dung môi không phân cực, thường được sử dụng làm nguyên liệu trong tổng hợp chất hữu cơ chứa lưu huỳnh và được sử dụng rộng rãi trong sản xuất vải viscoza mềm. A có công thức hydride dạng AH4 và D có công thức oxide ứng với hoá trị cao nhất dạng DO3.
a) Hãy thiết lập công thức phân tử của X. Biết rằng A có số oxi hoá cao nhất trong X.
b) Đề xuất công thức cấu tạo của X và cho biết các nguyên tử thành phần của X khi liên kết có đủ electron theo quy tắc octet không.
a) A thuộc nhóm IVA và D thuộc nhóm VIA ⇒ số oxi hoá cao nhất của A trong X là + 4 còn số oxi hoá của D trong X là - 2.
Công thức phân tử X có dạng AD2. Ta có: A + 2D= 76.
⇒ Nguyên tử khối trung bình của A, D là: 76 : 3 = 25,33.
⇒ A và D thuộc chu kì 2, 3 ⇒ Có các cặp nguyên tố sau:
C = 12 và O = 16; C = 12 và S = 32; Si = 28 và O = 16; Si = 28 và S = 32.
C = 12 và S = 32 thoả mãn A + 2D = 76 ⇒ Công thức X: CS2.
b) Đề xuất công thức cấu tạo: ![]() có cấu trúc thẳng giống CO2.
có cấu trúc thẳng giống CO2.
Các nguyên tử C và S đều có 8 electron lớp ngoài cùng theo quy tắc octet.
Đừng quên tham khảo tài liệu giải vở bài tập Hoá 10 Kết Nối Tri Thức của Giaibaitapsgk. Dựa vào đó các em học sinh có thể nhanh chóng hoàn thành bài tập về nhà của mình.
Giaibaitapsgk cũng còn rất nhiều tài liệu học tốt siêu hay khác chờ các em khám phá: bộ đề thi Hoá 10, ngân hàng câu hỏi trắc nghiệm Vật lí, giải vở bài tập 10 Kết Nối Tri Thức,... Hy vọng những tài liệu mà chúng tôi cung cấp sẽ giúp các em rút ngắn thời gian làm bài, giảm bớt áp lực học hành.
