Trắc nghiệm KHTN 7 chân trời bài 6 Giới thiệu về liên kết hóa học
Dưới đây là toàn bộ nội dung hướng dẫn giải bài tập lớp 7 sách Chân Trời Sáng Tạo theo chương trình mới. Hơn 30 bài học được chúng tôi chia thành những cụm chủ đề chính, mỗi cụm chủ đề lại có những bài học liên quan đến nhau nên sẽ dễ dàng tra cứu, ôn tập. Mỗi câu hỏi đều sẽ được lồng ghép tình huống và hình ảnh sinh động gắn liền với thực tiễn cuộc sống.
Bài trắc nghiệm có đáp án. Câu hỏi và bài tập trắc nghiệm KHTN 7 chân trời bài 6 Giới thiệu về liên kết hóa học - sách chân trời sáng tạo. Học sinh luyện tập bằng cách chọn đáp án của mình trong từng câu hỏi. Dưới cùng của bài trắc nghiệm, có phần xem kết quả để biết bài làm của mình. Kéo xuống dưới để bắt đầu.
Câu 1: Phát biểu nào sau đây đúng?
- A. Tất cả các nguyên tố khí hiếm đều có 8 electron ở lớp electron ngoài cùng.
- B. Vỏ nguyên tử của các nguyên tố khí hiếm đều có cùng số lớp electron,
- C. Hợp chất tạo bởi các nguyên tố khí hiếm đều ở thể khí.
D. Các nguyên tố khí hiếm đều rất khó hoặc không kết hợp với nguyên tố khác hợp thành hợp chất.
Câu 2: Vỏ nguyên tử của các nguyên tố khí hiếm thường chứa bao nhiêu electron ở lớp ngoài cùng?
- A. 5.
- B. 6.
- C. 7.
D. 8.
Câu 3: Hãy chọn phát biểu đúng để hoàn thành câu sau: Để có số electron ở lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm, các nguyên tử của các nguyên tố có khuynh hướng
- A. nhường các electron ở lớp ngoài cùng.
- B. nhận thêm electron vào lớp electron ngoài cùng.
C. nhường electron hoặc nhận electron hoặc góp chung electron.
- D. nhường electron hoặc nhận electron để lớp electron ngoài cùng đạt trạng thái bền (8 electron).
Câu 4: Trong các phản ứng hóa học, nguyên tử kim loại có khuynh hướng
- A. Nhận thêm electron.
B. Nhường bớt electron.
- C. Nhận hay nhường electron phụ thuộc vào từng phản ứng cụ thể.
- D. Nhận hay nhường electron phụ thuộc vào từng kim loại cụ thể.
Câu 5: Trong các phản ứng hóa học, nguyên tử phi kim có khuynh hướng
A. Nhận thêm electron.
- B. Nhận hay nhường electron phụ thuộc vào từng phản ứng cụ thể.
- C. Nhường bớt electron.
- D. Nhận hay nhường electron phụ thuộc vào từng kim loại cụ thể.
Câu 6: Phát biểu nào sau đây đúng?
- A. Để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhường các electron ở lớp ngoài cùng.
- B. Để tạo ion dương thì nguyên tử của nguyên tố phi kim sẽ nhận thêm electron để có đủ 8 electron ở lớp electron ngoài cùng.
- C. Để tạo ion dương thì nguyên tử của nguyên tố kim loại sẽ nhận thêm electron để có đủ 8 electron ở lớp electron ngoài cùng.
D. Để tạo ion dương thì nguyên tử của nguyên tố hóa học sẽ nhường các electron ở lớp ngoài cùng.
Câu 7: Phát biểu nào sau đây đúng?
- A. Nguyên tố tạo ion dương có thể là nguyên tố kim loại hoặc nguyên tố phi kim.
B. Nguyên tố tạo ion âm đều là nguyên tố phi kim.
- C. Để tạo ion dương thì nguyên tố phi kim sẽ nhường electron.
- D. Để tạo ion âm thì nguyên tố kim loại sẽ nhận electron.
Câu 8: Phát biểu nào sau đây đúng?
- A. Để tạo ion âm thì nguyên tử của nguyên tố phi kim sẽ nhường các electron lớp ngoài cùng.
B. Để tạo ion âm thì nguyên tử của nguyên tố phi kim sẽ nhận thêm electron để có đủ 8 electron ở lớp electron ngoài cùng.
- C. Để tạo ion âm thì nguyên tử của nguyên tố kim loại sẽ nhận thêm electron để có đủ 8 electron ở lớp ngoài cùng.
- D. Để tạo ion âm thì nguyên tử của nguyên tố hóa học sẽ nhường các electron ở lớp ngoài cùng.
Câu 9: Cho các ion: Na+, SO42-, Fe3+, Cl-, NH4+, NO3-. Có bao nhiêu ion âm?
A. 3.
- B. 4.
- C. 5.
- D. 6.
Câu 10: Phát biểu nào sau đây không đúng?
- A. Liên kết trong các phân tử đơn chất thường là liên kết cộng hóa trị.
B. Liên kết giữa nguyên tố kim loại và nguyên tố phi kim đều là liên kết ion.
- C. Liên kết giữa các nguyên tố phi kim thường là liên kết cộng hóa trị.
- D. Sau khi các nguyên tử liên kết với nhau, số electron lớp ngoài cùng sẽ giống nguyên tố khí hiếm.
Câu 11: Liên kết hóa học giữa các nguyên tử oxygen và hydrogen trong phân tử nước được hình thành bằng cách
- A. nguyên tử oxygen nhận electron, nguyên tử hydrogen nhường electron.
- B. nguyên tử oxygen nhường electron, nguyên tử hydrogen nhận electron.
C. nguyên tử oxygen và nguyên tử hydrogen góp chung electron.
- D. nguyên tử oxygen và nguyên tử hydrogen góp chung proton.
Câu 12: Ở điều kiện thường, phát biểu nào sau đây đúng?
- A. Tất cả các hợp chất ở thể rắn đều là chất ion.
- B. Chất cộng hóa trị luôn ở thể rắn.
- C. Chất chỉ có liến kết cộng hóa trị là chất cộng hóa trị và luôn ở thể khí.
D. Hợp chất có chứa kim loại thường là chất ion.
Câu 13: Cho mô hình mô phỏng phân tử methane
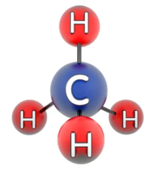
Liên kết giữa các nguyên tử trong phân tử methane là liên kết
- A. kim loại.
- B. ion.
C. cộng hóa trị.
- D. phi kim.
Câu 14: Phát biểu nào sau đây đúng?
- A. Hợp chất ion và chất cộng hóa trị đều bền với nhiệt.
- B. Hợp chất ion và chất cộng hóa trị đều tan tốt trong nước.
C. Các chất ion luôn ở thể rắn.
- D. Khi các chất ion và chất cộng hóa trị tan trong nước đều tạo dung dịch có khả năng dẫn điện được.
Câu 15: Trong phân tử KCl, nguyên tử K (potassium) và nguyên tử Cl (chlorine) liên kết với nhau bằng liên kết
- A. cộng hóa trị.
B. ion.
- C. kim loại.
- D. phi kim.
Câu 16: Có các phát biểu sau:
(a) Trong hợp chất, kim loại luôn nhường electron, phi kim luôn nhận electron.
(b) Để có 8 electron ở lớp vỏ ngoài cùng thì nguyên tử aluminium hoặc nhường 3 electron hoặc nhận 5 electron.
(c) Liên kết trong hợp chất tạo bởi magnesium và chlorine là liên kết ion.
(d) Trong phân tử, hợp chất gồm các nguyên tố C, H, O chỉ có liên kết cộng hóa trị.
(e) Khi tạo liên kết hóa học, nguyên tử chlorine chỉ tạo ion âm bằng cách nhận thêm 1 electron.
Số phát biểu đúng là
- A. 1.
B. 2.
- C. 3.
- D. 4.
Câu 17: Phát biểu nào sau đây không đúng?
- A. Hợp chất chỉ có liên kết cộng hóa trị là chất cộng hóa trị.
- B. Hợp chất chỉ có liên kết ion là chất ion.
- C. Một số hợp chất có cả liên kết ion và liên kết cộng hóa trị.
D. Ở điều kiện thường, hợp chất ở thể rắn là chất ion.
Câu 18: Có các phát biểu sau:
(a) Ở điều kiện thường, các chất ion ở thể rắn.
(b) Ở điều kiện thường, các hợp chất ở thể lỏng đều là chất cộng hóa trị.
(c) Hợp chất của kim loại khó bay hơi, khó nóng chảy, dễ tan trong nước tạo dung dịch dẫn được điện.
(d) Hợp chất chỉ gồm các nguyên tố phi kim thường dễ bay hơi, kém bền với nhiệt.
(e) Hợp chất tan được trong nước thành dung dịch không dẫn điện thường là chất cộng hóa trị
Số phát biểu đúng là
A. 5.
- B. 4.
- C. 3.
- D. 2.
Câu 19: Có các phát biểu sau:
(a) Tất cả các chất ion đều ở thể rắn.
(b) Tất cả các chất ion đều tan trong nước tạo thành dung dịch có khả năng dẫn điện.
(c) Khi đun sodium chloride rắn ở nhiệt độ cao sẽ được sodium chloride lỏng dẫn điện.
(d) Đường tinh luyện và muối ăn đều là chất rắn tan được trong nước tạo dung dịch dẫn điện.
Số phát biểu đúng là
- A. 1.
- B. 2.
C. 3.
- D. 4.
Câu 20: Cho mô hình sắp xếp các electron trong vỏ nguyên tử Mg và nguyên tử Ne:
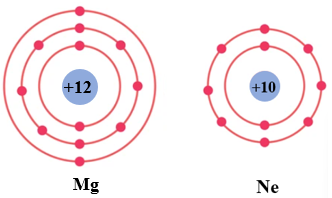
Để đạt được lớp vỏ bền vững giống vỏ nguyên tử khí hiếm Ne thì nguyên tử Mg cần nhường hay nhận bao nhiêu electron?
A. nhường 2 electron.
- B. nhường 6 electron.
- C. nhận 2 electron.
- D. nhận 6 electron.
Câu 21: Phân tử nước gồm một nguyên tử oxygen liên kết với hai nguyên tử hydrogen. Khi hình thành liên kết cộng hóa trị trong phân tử nước, nguyên tử oxygen góp chung bao nhiêu electron với mỗi nguyên tử hygrogen?
- A. Nguyên tử oxygen góp chung 4 electron với mỗi nguyên tử hygrogen.
- B. Nguyên tử oxygen góp chung 3 electron với mỗi nguyên tử hygrogen.
- C. Nguyên tử oxygen góp chung 2 electron với mỗi nguyên tử hygrogen.
D. Nguyên tử oxygen góp chung 1 electron với mỗi nguyên tử hygrogen.
Ngoài ra chúng tôi cũng hướng dẫn giải bài tập lớp 7 sách Chân Trời Sáng Tạo chi tiết theo từng trang. Tham khảo tài liệu này giúp các em nhanh chóng chuẩn bị bài mới, trả lời những câu hỏi có liên quan tới bài học của mình.
Nếu thấy bộ hướng dẫn giải bài tập lớp 7 Chân Trời Sáng Tạo của Giaibaitapsgk hữu ích thì đừng quên theo dõi chúng tôi để cập nhật thêm nhiều kiến thức hữu ích khác. Mong rằng bộ tài liệu sẽ giúp các em rút ngắn thời gian học tập mà vẫn có thể đạt được mục tiêu của bản thân. Chúc các em giành được điểm số cao trong những kì thi sắp tới!
